Será para médicos y población vulnerable
Pide EU a estados alistarse para distribuir vacuna antiCOVID a partir de octubre
El gobierno de eu solicitó a 50 estados acelerar las instalaciones y renunciar a requisitos que retrasen la fecha; usarían prototipos contra el Covid-19 de Moderna y Pfizer
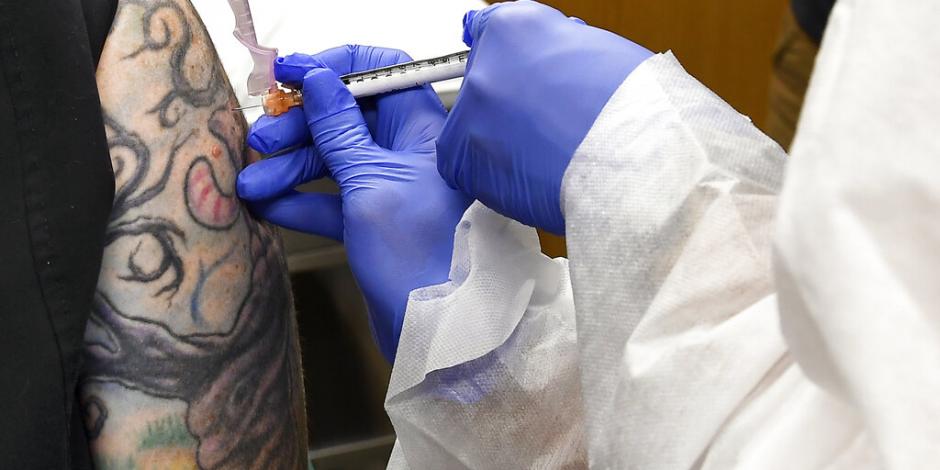
El gobierno de Estados Unidos, a través de los Centros para el Control de las Enfermedades (CDC, por sus siglas en inglés) informó a al menos 50 estados y cinco ciudades importantes que es necesario que se preparen para comenzar a distribuir en cantidades limitadas las vacunas contra el Covid-19 entre finales de octubre y principios de noviembre, de cara a las elecciones presidenciales.
El 27 de agosto, cuatro días después que Financial Times reportara que la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) estaba considerando la aprobación de emergencia de una vacuna, un movimiento hecho semanas atrás por Rusia y que causó preocupación entre funcionarios de Estados Unidos, Robert Redfield, director de los CDC habría enviado una carta a los gobernadores donde detallaba que “en un futuro cercano” recibirán solicitudes de una empresa contratada por el gobierno para distribuir vacunas a lugares que incluyen hospitales y departamentos de salud estatales y locales.
“Los CDC solicita urgentemente su ayuda para acelerar las solicitudes para estas instalaciones de distribución y, si es necesario, le pide que considere la posibilidad de renunciar a los requisitos que evitarían que estas instalaciones estén completamente operativas para el 1 de noviembre de 2020”, escribió Redfield, de acuerdo con la carta publica por The Associated Press.
Entrevistado por un medio local, Redfield dijo que los funcionarios se estaban preparando “para lo que anticipo que será la realidad, es que habrá una o más vacunas disponibles para nosotros en noviembre, diciembre”.
De acuerdo con The New York Times, las dosis se dirigirían a personal médico y grupos vulnerables, tal como han adelantado en semanas previas tanto Anthony Fauci, el principal experto en enfermedades infecciosas del país, como el Dr. Stephen Hahn, quien dirige la FDA.
El documento, según ese medio, da especificaciones técnicas para dos candidatos descritos como Vacuna A y Vacuna B, cuyos detalles parecen coincidir con los productos desarrollados por Pfizer y Moderna, que son los más avanzados en los ensayos clínicos de última etapa.
El 20 de agosto, Pfizer dijo que estaba “en camino” para solicitar una revisión del gobierno “ya en octubre de 2020”.
Expertos citados por The Associated Press advirtieron que apenas se encuentra en proceso el reclutamiento de los voluntarios para la tercera etapa de las pruebas y, en el mejor de los casos, se encuentran a la mitad de ese proceso.
“Estar listo es razonable. Cortar los ensayos de fase 3 antes de obtener la información que necesita no lo es ”, dijo el Paul Offit, un experto en inmunización del Children’s Hospital of Philadelphia que forma parte del comité asesor de vacunas de la FDA.
“La comunidad de salud pública quiere una vacuna segura y eficaz tanto como cualquiera podría quererla. Pero los datos deben ser claros y convincentes, que la vacuna sea eficaz y segura”, dijo Michael Osterholm, un experto en enfermedades infecciosas de la Universidad de Minnesota.
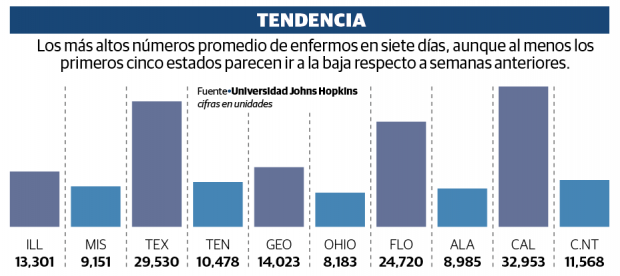
- El dato: Los resultados preliminares de una encuesta realizada durante los últimos tres meses en 19 países mostraron que sólo 70% de los encuestados británicos y estadounidenses tomarían una vacuna Covid-19 si estuviera disponible.
kl
-
Bebé Reno: ¿Quién es en la vida real Martha, de la perturbadora serie de Netflix? | VIDEO
-
¿Quién es la mamá de Peso Pluma y a qué se dedica?
-
Resultados del Tris de hoy 25 de abril del 2024. Ve aquí los números ganadores
-
¿Qué pasó con Elizabeth Parker en la vida real? Así fue su trágico final
-
En Ecuador denuncian a Canseco


