La administración Trump otorgó una autorización de emergencia al tratamiento con plasma de pacientes que se han recuperado de Covid-19 y generaron anticuerpos para tratar a otros enfermos, en un esfuerzo del presidente estadounidense por demostrar control sobre la pandemia, luego de que recibiera críticas en ese sentido la semana anterior, durante la Convención Nacional Demócrata.
El anuncio, también tuvo como objetivo que las agencias federales de salud “sientan la presión” por acelerar la aprobación de una vacuna, según explicó horas antes Mark Meadows, jefe de gabinete de la Casa Blanca.
La autorización para el uso del plasma convaleciente fue anunciada por Donald Trump la tarde de ayer, cuando citó a la prensa para informar el avance, que calificó como “histórico”.
“Esta es una terapia poderosa que transfunde anticuerpos muy, muy fuertes de la sangre de pacientes recuperados para ayudar a tratar a los pacientes que luchan contra una infección actual. Ha tenido una tasa de éxito increíble”, dijo.
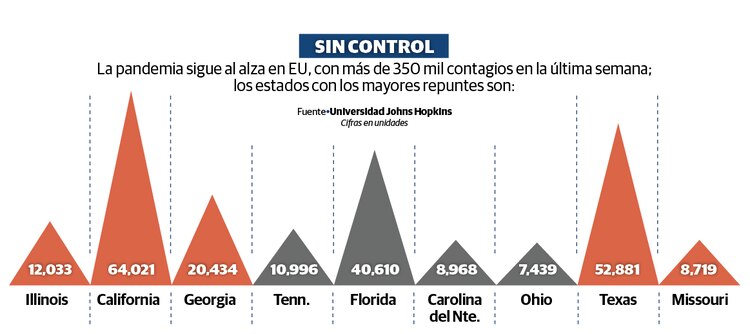
Trump se apegó a sus puntos de conversación, se remitió al jefe de la FDA, Stephen Hahn, y sólo respondió a tres preguntas de los periodistas, por lo que más que un intercambio con los reporteros, el evento tuvo reminiscencias de un acto de campaña, previo a la Convención Nacional Republicana, que inicia hoy.
La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés), en un comunicado, declaró que la evidencia preliminar sugiere que el plasma sanguíneo puede disminuir la mortalidad y mejorar la salud cuando se administra en los primeros días de hospitalización.
La agencia también dijo que determinó que este era un enfoque seguro en un análisis de 20 mil pacientes que recibieron este tratamiento; hasta ahora, 70 mil enfermos han sido tratados con plasma sanguíneo, precisó, y “los beneficios conocidos y potenciales del producto superan los riesgos conocidos y potenciales”.
Los pacientes que más se beneficiaron, detalló, fueron los menores de 80 años que no usaban respirador, dijo la agencia.
“El plasma convaleciente Covid-19 no debe considerarse un nuevo estándar de atención para el tratamiento de pacientes. En los próximos meses se obtendrán datos adicionales de otros análisis y ensayos clínicos en curso y bien controlados”, matizó la FDA el entusiasmo de Trump.
En el mismo sentido, la Sociedad Estadounidense de Enfermedades Infecciosas advirtió que, si bien hay “algunas señales positivas de que el plasma convaleciente puede ser útil (...) sus beneficios deben demostrarse en ensayos clínicos que asignen pacientes al azar a recibir plasma o un placebo antes de que se autorice”.
Previo al anuncio, se había generado una gran expectativa, debido a que desde el sábado la portavoz de la Casa Blanca, Kaleigh McEnany dijo que se trataba de un “avance terapéutico”; esto fue aumentado cuando ayer por la mañana el presidente Trump escribió que se trataba de “muy buenas noticias”.

Algunos datos apuntaban a que podía estar relacionado con las vacunas en desarrollo, luego de las acusaciones lanzadas por Trump un día antes, a través de un tuit en el que etiquetó al comisionado de la FDA, Stephen Hahn, y acusó la existencia de un “Estado profundo” al interior de la FDA, que estaría retrasando la aprobación hasta después de las elecciones.
Asimismo, ayer se reportó que, al igual que hizo Rusia con el prototipo de vacuna contra el Covid-19 desarrollado por el Instituto Gamaleya y el Ministerio de Defensa, al cual le otorgaron la aprobación para su producción y aplicación a gran escala aun sin concluir las pruebas de seguridad, Estados Unidos estaría considerando hacer un movimiento similar.
Se trata de la vacuna experimental que desarrollan AstraZeneca y la Universidad de Oxford, que se encuentra en estudios de Fase III en Inglaterra, India, Brasil, Sudáfrica y Estados Unidos, a la cual las autoridades estadounidenses les darían un pase de “autorización de uso de emergencia”, de acuerdo con reportes del medio estadounidense Financial Times.
Dicho medio, que señala haber consultado a funcionarios, detalló que la aprobación podría ocurrir en octubre, antes de las elecciones presidenciales, una vez que se cuente con “los resultados de un estudio relativamente pequeño del Reino Unido”.
Sin embargo, la farmacéutica británica reaccionó y advirtió que era “prematuro especular sobre esa posibilidad”, debido a que “no ha discutido la autorización de uso de emergencia” con Estados Unidos.
El Financial Times agregó que “hacer que una vacuna esté disponible antes de las elecciones podría permitir al presidente afirmar que ha cambiado el rumbo de un virus que ha matado a más de 170,000 estadounidenses”.